ROS1
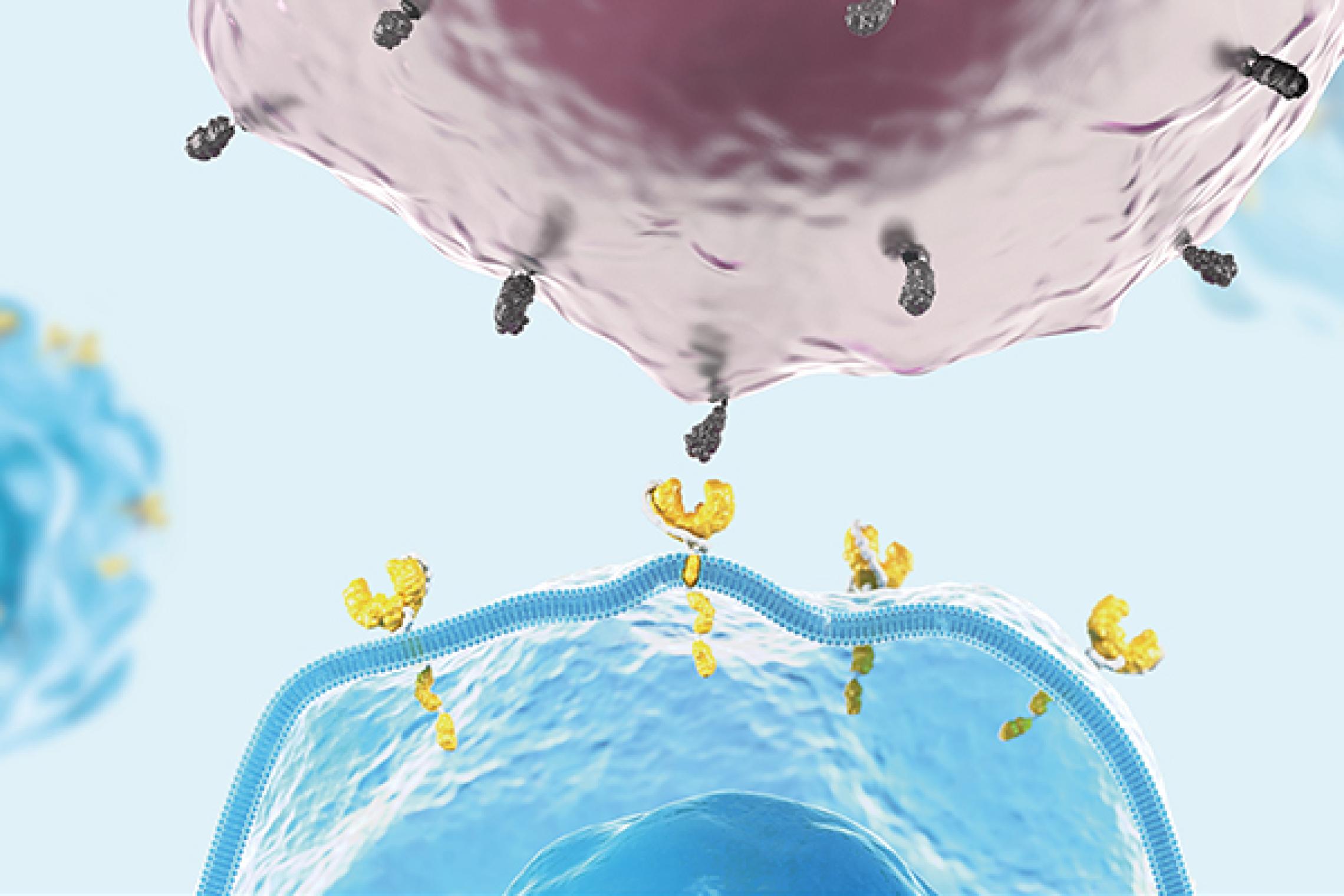
ROS1 ist ein Gen, das für ein Protein kodiert, welches als Rezeptor-Tyrosinkinase fungiert. Dieses Protein spielt eine wichtige Rolle in der Zellkommunikation und
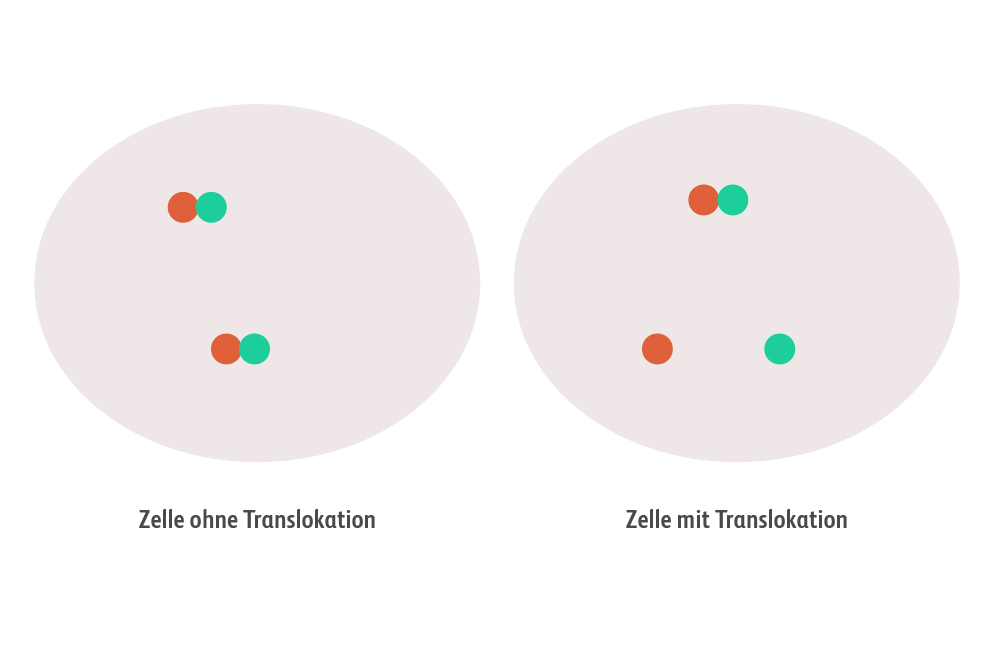
-regulation, insbesondere in Bezug auf Zellwachstum und -differenzierung. In der Onkologie ist ROS1 von besonderem Interesse, da es bei verschiedenen Krebsarten genetische Veränderungen, sogenannte Translokationen, aufweisen kann. Diese führen zur Bildung von abnormen Proteinen, die zur dauerhaften Aktivierung verschiedener Signalwege führen und so das Zellwachstum unkontrolliert fördern kann. Diese abnormen Proteine sind oft treibende Faktoren bei der Entstehung und dem Fortschreiten bestimmter Krebsarten. Der ROS1-Signalweg ist daher ein wichtiger therapeutischer Ansatzpunkt in der Krebsbehandlung.
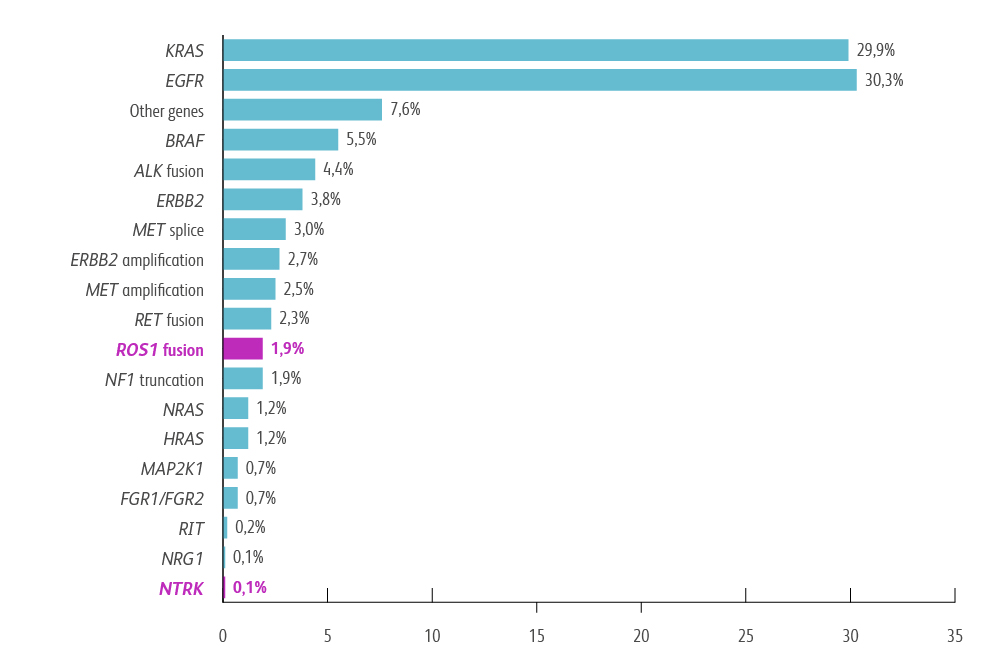
ROS1-Fusionen entstehen, wenn das ROS1-Gen mit einem anderen Gen zusammengeführt wird. Dies führt zur Bildung eines Fusionsproteins, das eine unregulierte Tyrosinkinase-Aktivität aufweist. Diese unkontrollierte Aktivität kann das Zellwachstum und die Zellteilung fördern, was zur Tumorbildung führt. Bekannte ROS1-Fusionspartner sind unter anderem CD74, SLC34A2, EZR, und SDC4.