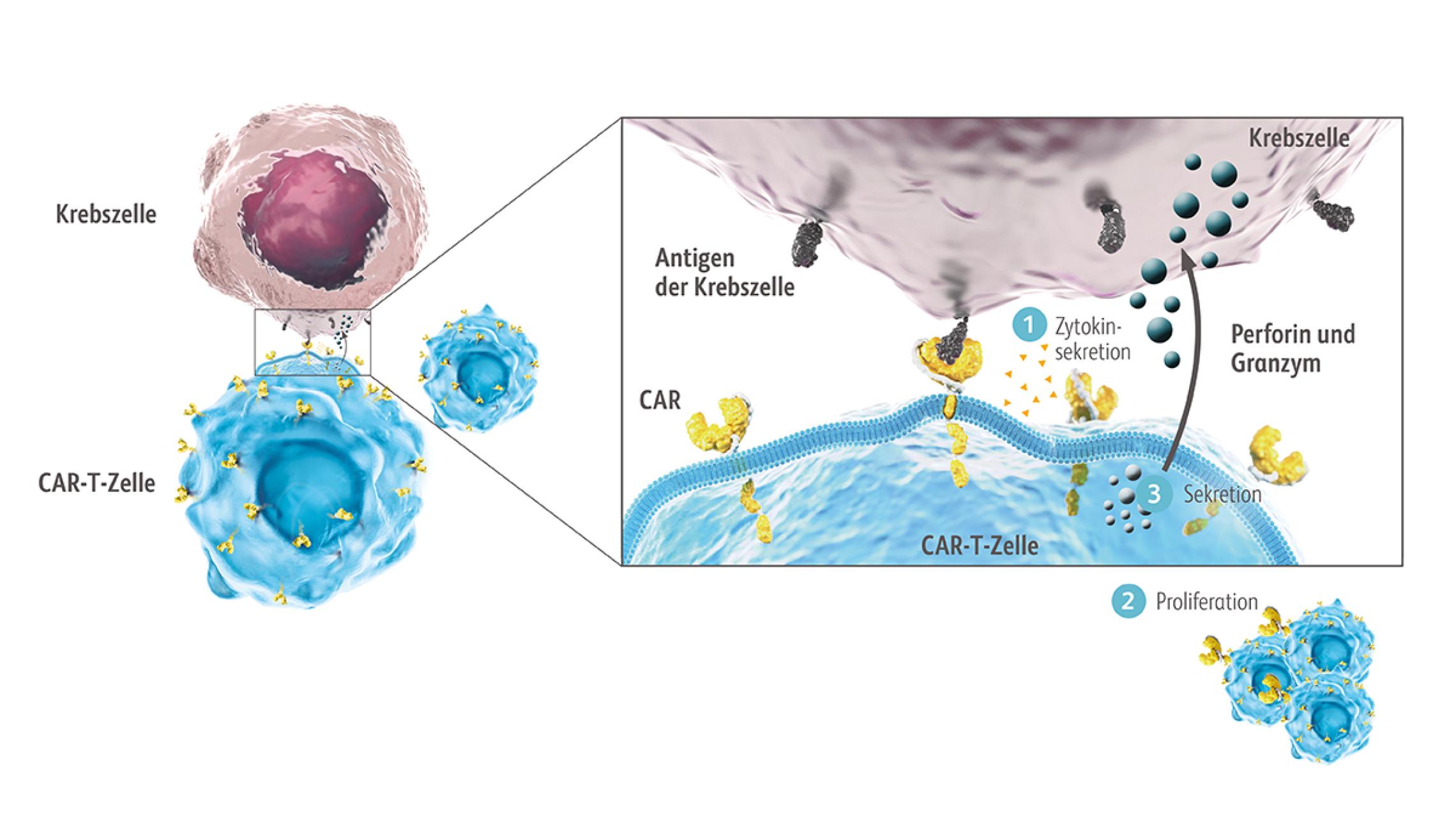
Chimärer Antigenrezeptor (CAR)
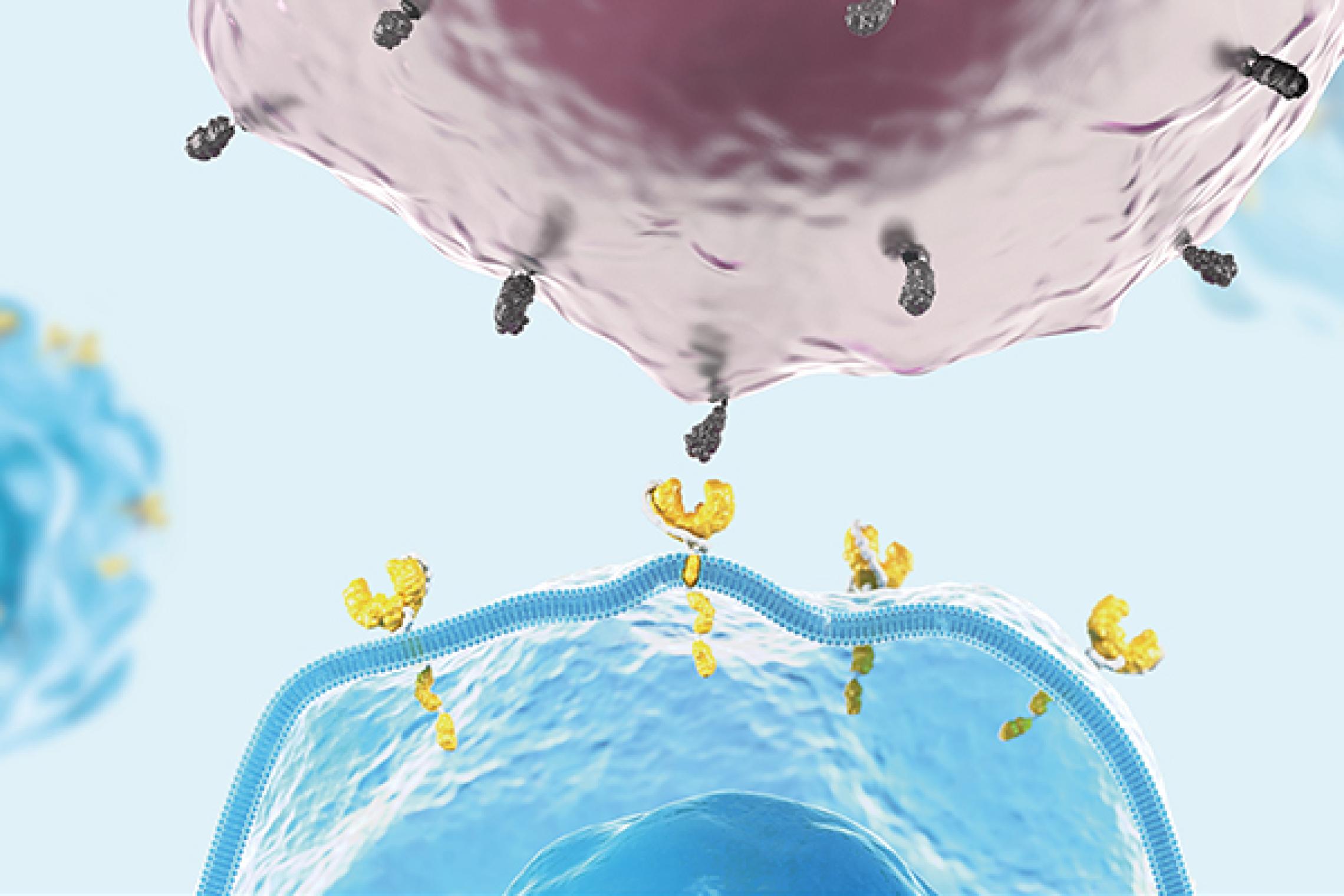
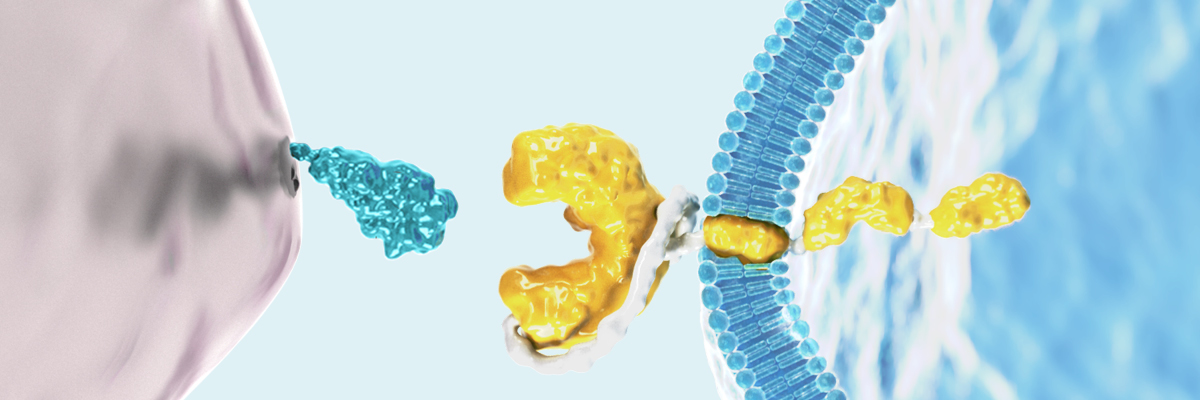
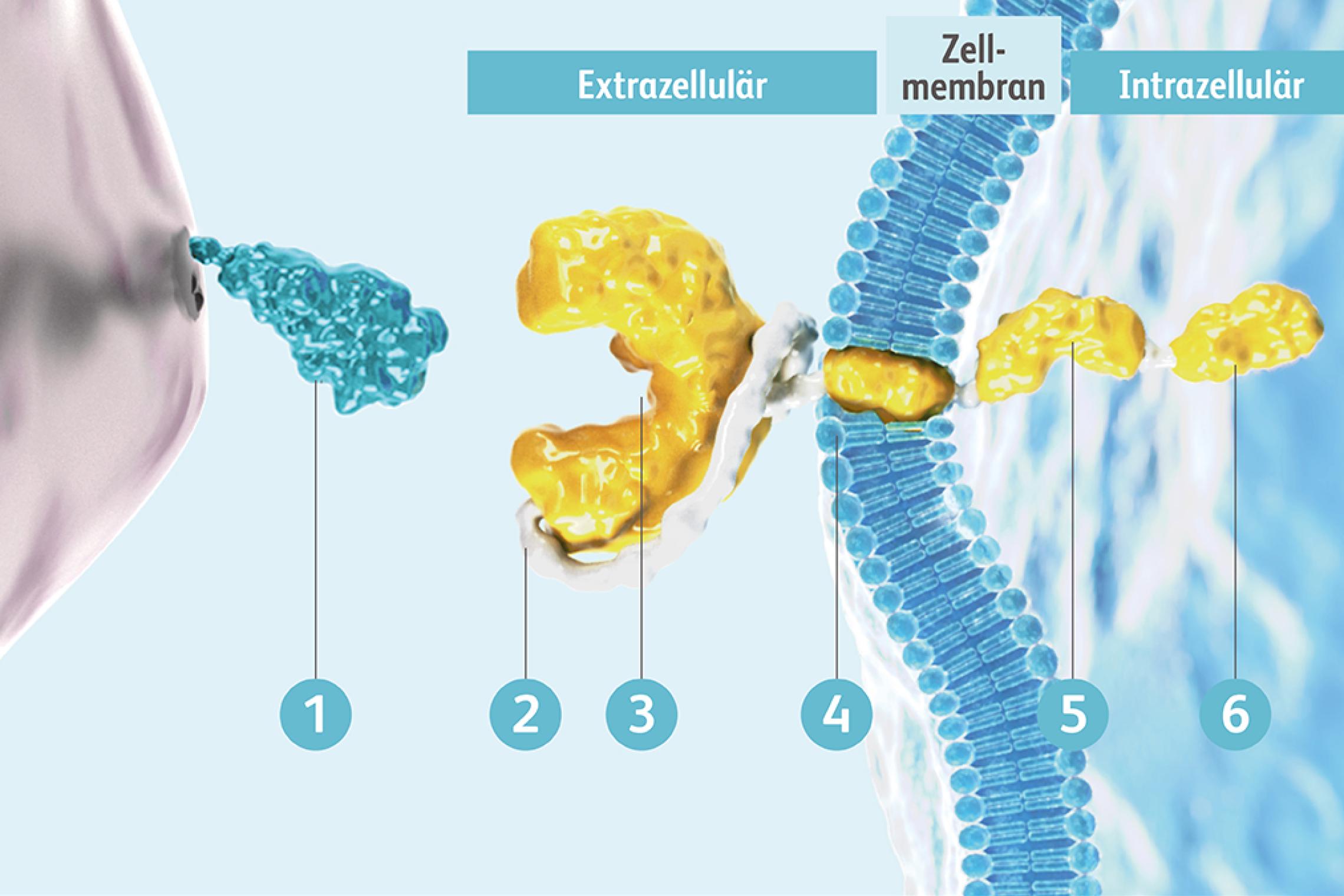
Der CAR ist ein eigens für die CAR-T-Zelltherapie entwickeltes Fusionsprotein, das verschiedene Mechanismen der T-Zell-Aktivierung in einem Protein vereint. Über diesen CAR können CAR-T-Zellen Antigene erkennen und binden, woraufhin die Aktivierungskaskade in die CAR-T-Zelle hinein weitergeleitet wird. Der CAR besteht aus einer extrazellulären Antigen-bindenden Domäne, einer Transmembrandomäne und einer intrazellulären Domäne. Die extrazelluläre Domäne ist vom Single-chain variable fragment (scFv)-Segment der Antigen-Bindungsregion eines monoklonalen Antikörpers abgeleitet. Die intrazellulären Domänen besitzen Bestandteile des T-Zell-Rezeptors und vermitteln die Aktivierung der CAR-T-Zellfunktion.